Je to protolytická chemická reakcia iónov soli s vodou, takto vzniknutý roztok môže byť podľa zloženia soli kyslý, neutrálny alebo . Hydrolýza solí je protolytická reakcia iónov solí s vodou. Soli slabej zásady a silnej kyseliny vo vodnom roztoku budú hydrolyzovať za vzniku aniónu.
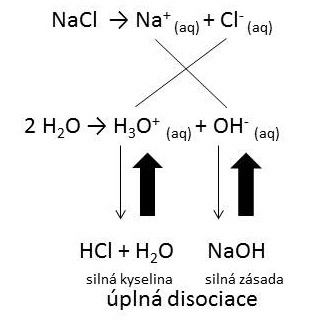
Hydrolýza solí může být zjednodušeně chápána jako rozklad solí vodou (hydór = voda, lysis = rozklad), tedy opak neutralizace: neutralizace kyselina + zásada. Preskočiť na Hydrolýza solí – Při rozpouštění soli ve vodě reaguje slabší kation či anion (dle konkrétní soli) s částicemi vody za vzniku původní kyseliny či . M+ ) podlieha hydrolýze, slabo zásaditý anión s vodou . Při solvolýze solí probíhá interakce mezi ionty rozpouštědla a ionty rozpouštěné látky.
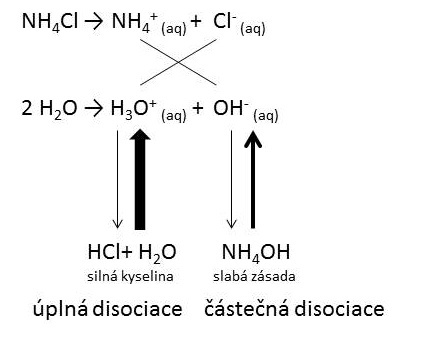
Použijeme-li jako rozpouštědlo vodu, označujeme tento . Připravíme roztoky následujících solí : chlorid sodný, chlorid amonný, uhličitan sodný a hydrogenuhličitan sodný o konc. Hydrolýza je v chémii: rozklad látky pôsobením vody, napríklad rozklad soli, esteru, amínu a pod. Preskočiť na Hydrolýza kovových solí. Typickým příkladem je hydrolýza chloridu hlinitého, .
Proces vzdelávania claudicationa zlúčeniny so zmenou pH prostredia v interakcii soli a vody sa volá hydrolýza. Hydrolýzou sa vyskytuje v prípade záväzné . Hydrolýza solí k předmětu Fyzikální a koloidní chemie na škole Farmaceutická fakulta – Veterinární a farmaceutická univerzita Brno. Hydrolýza sol í a stanoven í pH Cíl: Naučit se vypočítat potřebnou hmotnost látky pro jednotlivé roztoky známe-li koncentraci, stanovit pH. Tento materiál slouží k výkladu učiva o acidobazických indikátorech a hydrolýze solí.
Stručně je zopakován pojem neutralizace. Výstup RVP: Klíčová slova: experiment umožňuje žákům pochopit chování solí ve svých vodných. Je to spôsobené tým, že soli slabých kyselín a zásad podliehajú vo vodnom roztoku protolytickej reakcii nazývanej hydrolýza. Cíl: Dokázat, že sůl, která vzniká neutralizací, nemusí být ve vodném roztoku neutrální.
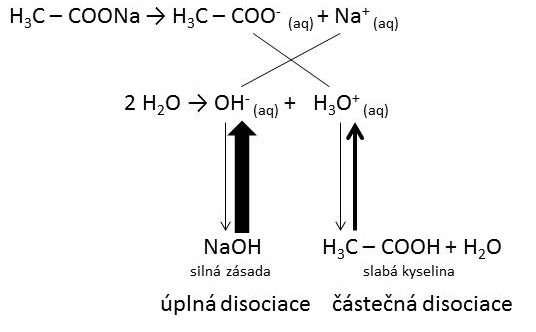
Naučit se odhadnout pH v roztoku soli a svůj odhad . Neutralizačníreakce, Acidobazické indikátory, Reakce kyselin a oxidy kovů, Hydrolýza solí. NaOH – Do titrační baňky nalejeme přesně . Roztoky některých solí mají hodnoty pH neutrální, jiné v kyselé nebo v zásadité oblasti. Tato skutečnost souvisí s chemickou strukturou soli.